objetivos de aprendizaje
al final de esta sección, podrá:
- Definir y explicar la efusión y difusión
- declarar la Ley de Graham y usarla para calcular las propiedades relevantes de los gases
Si alguna vez ha estado en una habitación cuando se le entregó una pizza caliente, se le ha informado el hecho de que las moléculas gaseosas pueden propagarse rápidamente por toda una habitación, como lo demuestra el agradable aroma que pronto llega a su nariz., Aunque las moléculas gaseosas viajan a velocidades tremendas (cientos de metros por segundo), chocan con otras moléculas gaseosas y viajan en muchas direcciones diferentes antes de alcanzar el objetivo deseado. A temperatura ambiente, una molécula gaseosa experimentará miles de millones de colisiones por segundo. El camino libre medio es la distancia media que recorre una molécula entre colisiones., El camino libre Medio aumenta con la disminución de la presión; en general, el camino libre medio para una molécula gaseosa será cientos de veces el diámetro de la molécula
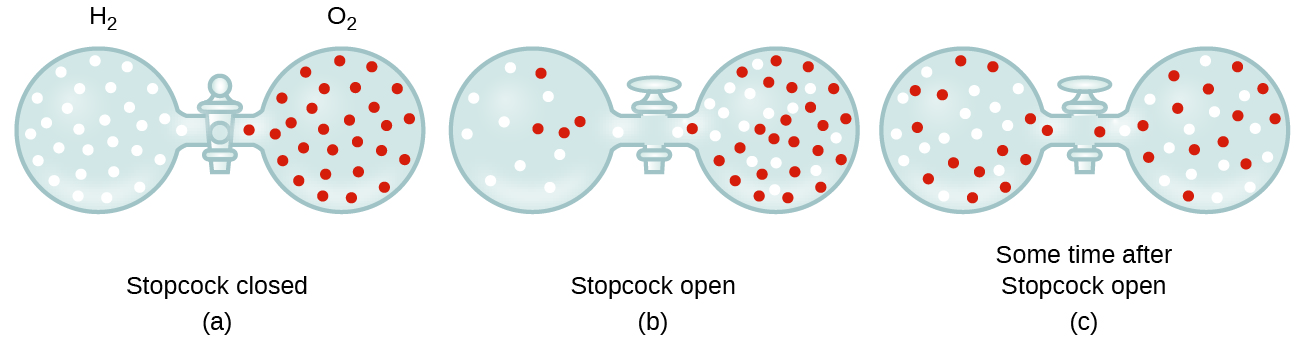
en general, sabemos que cuando una muestra de gas se introduce en una parte de un contenedor cerrado, sus moléculas se dispersan muy rápidamente en todo el contenedor; este proceso por el cual las moléculas se dispersan en el espacio en respuesta a las diferencias en la concentración se llama difusión (se muestra en la Figura 1)., Los átomos gaseosos o las moléculas son, por supuesto, inconscientes de cualquier gradiente de concentración, simplemente se mueven al azar: las regiones de mayor concentración tienen más partículas que las regiones de concentraciones más bajas, por lo que se produce un movimiento neto de especies de áreas de alta a baja concentración. En un entorno cerrado, la difusión dará lugar en última instancia a concentraciones iguales de gas en todo, como se muestra en la Figura 1., Los átomos gaseosos y las moléculas continúan moviéndose, pero como sus concentraciones son las mismas en ambos bulbos, las tasas de transferencia entre los bulbos son iguales (no se produce una transferencia neta de moléculas).
a menudo nos interesa la tasa de difusión, la cantidad de gas que pasa a través de un área por unidad de tiempo:
la velocidad de difusión depende de varios factores: el gradiente de concentración (el aumento o disminución de la concentración de un punto a otro); la cantidad de superficie disponible para la difusión; y la distancia que deben recorrer las partículas de gas., Tenga en cuenta también que el tiempo requerido para que ocurra la difusión es inversamente proporcional a la tasa de difusión, como se muestra en la ecuación de la tasa de difusión.
un proceso que involucra el movimiento de especies gaseosas similar a la difusión es la efusión, el escape de moléculas de gas a través de un pequeño agujero como un agujero de alfiler en un globo hacia el vacío (Figura 2). Aunque las tasas de difusión y efusión dependen de la masa molar del gas involucrado, sus tasas no son iguales; sin embargo, las proporciones de sus tasas son las mismas.,
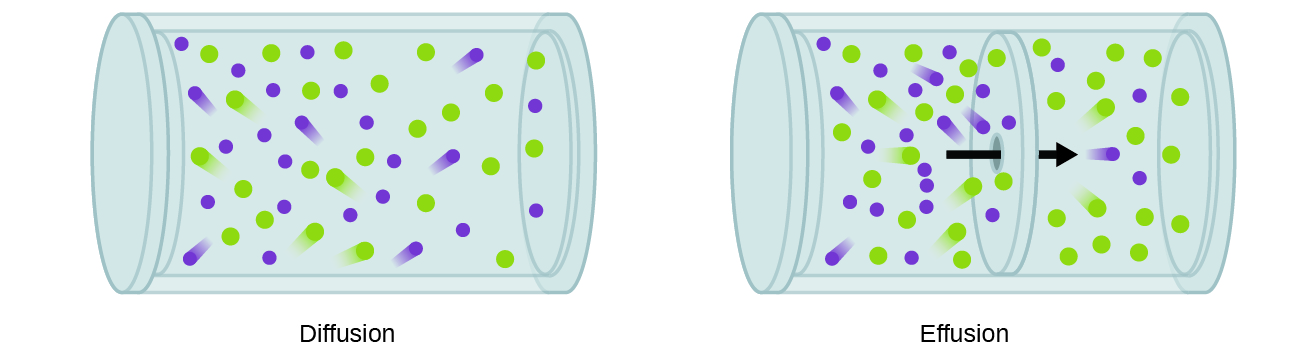
Si se coloca una mezcla de gases en un recipiente con paredes porosas, los gases se derraman a través de las pequeñas aberturas en las paredes. Los gases más ligeros pasan a través de las pequeñas aberturas más rápidamente (a una velocidad mayor) que los más pesados (Figura 3).,las partículas:
Esto significa que si dos gases a y B están a la misma temperatura y presión, la relación de sus las tasas de efusión es inversamente proporcional a la relación de la raíz cuadrada de la masa de sus partículas:

Aquí hay otro ejemplo, haciendo el punto sobre cómo la determinación de los tiempos difiere de la determinación de las tasas.,
finalmente, aquí hay un ejemplo más que muestra cómo calcular la masa molar A partir de los datos de velocidad de efusión.
uso de la difusión para aplicaciones de energía Nuclear: enriquecimiento de uranio
la difusión gaseosa se ha utilizado para producir uranio enriquecido para su uso en plantas de energía nuclear y armas. El uranio natural contiene solo 0.72% de 235U, el tipo de uranio que es «fisible», es decir, capaz de sostener una reacción en cadena de fisión nuclear. Los reactores nucleares requieren combustible que es 2-5% 235U, y las bombas nucleares necesitan concentraciones aún más altas., Una forma de enriquecer uranio a los niveles deseados es aprovechar la Ley de Graham. En una planta de enriquecimiento por difusión gaseosa, el hexafluoruro de uranio (UF6, el único compuesto de uranio que es lo suficientemente volátil como para funcionar) se bombea lentamente a través de grandes recipientes cilíndricos llamados difusores, que contienen barreras porosas con aberturas microscópicas. El proceso de difusión, porque el otro lado de la barrera no es evacuado. Las moléculas 235UF6 tienen una velocidad promedio más alta y se difunden a través de la barrera un poco más rápido que las moléculas más pesadas 238UF6., El gas que ha pasado a través de la barrera se enriquece ligeramente en 235UF6 y el gas residual se agota ligeramente. La pequeña diferencia en los pesos moleculares entre 235UF6 y 238uf6 solo alrededor del 0,4% de enriquecimiento, se logra en un difusor (Figura 4). Pero al conectar muchos difusores en una secuencia de etapas (llamada cascada), se puede alcanzar el nivel deseado de enriquecimiento.
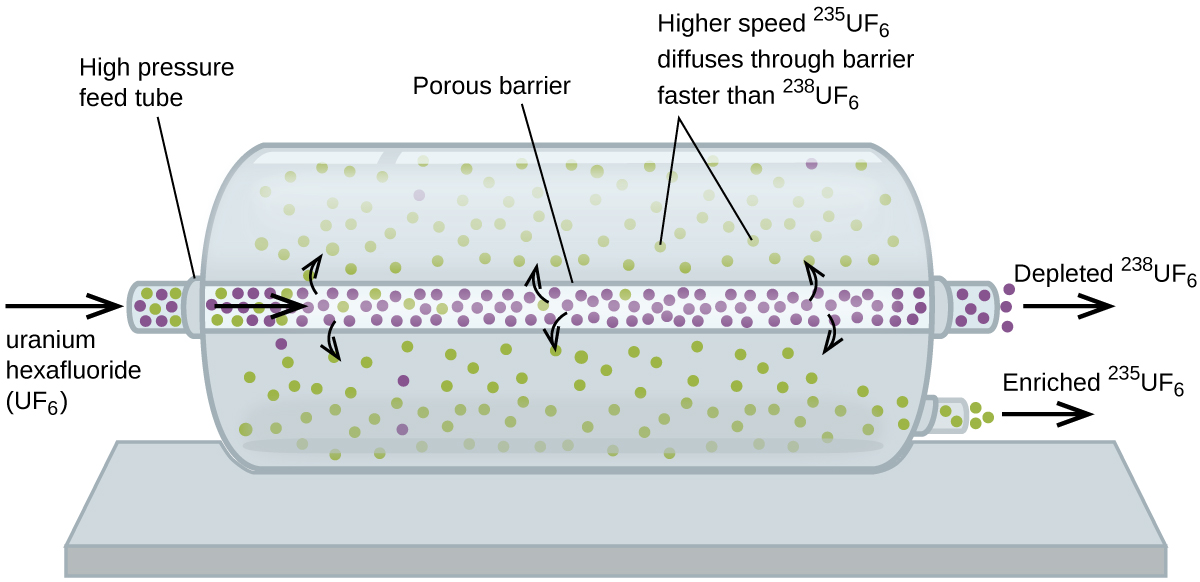
la separación a gran escala de 235uf6 gaseoso 238uf6 se hizo por primera vez durante la Segunda Guerra Mundial, en la instalación de energía atómica en Oak Ridge, Tennessee, como parte del Proyecto Manhattan (el desarrollo de la primera bomba atómica)., Aunque la teoría es simple, esto requirió superar muchos desafíos técnicos desalentadores para que funcionara en la práctica. La barrera debe tener agujeros diminutos y uniformes (aproximadamente 10-6 cm de diámetro) y ser lo suficientemente porosa como para producir altos caudales. Todos los materiales (la barrera, los tubos, los recubrimientos superficiales, los lubricantes y las juntas) deben poder contener, pero no reaccionar con, el UF6 altamente reactivo y corrosivo.,
debido a que las plantas de difusión gaseosa requieren cantidades muy grandes de energía (para comprimir el gas a las altas presiones requeridas y conducirlo a través de la cascada del difusor, para eliminar el calor producido durante la compresión, etc.), ahora está siendo reemplazado por la tecnología de centrífuga de gas, que requiere mucha menos energía. Un tema político candente actual es cómo negar esta tecnología a Irán, para evitar que produzca suficiente uranio enriquecido para que lo usen para fabricar armas nucleares.
los átomos y moléculas gaseosas se mueven libremente y al azar a través del espacio., La difusión es el proceso mediante el cual los átomos y moléculas gaseosas se transfieren de regiones de concentración relativamente alta a regiones de concentración relativamente baja. La efusión es un proceso similar en el que las especies gaseosas pasan de un contenedor a un vacío a través de orificios muy pequeños. Las tasas de efusión de gases son inversamente proporcionales a las raíces cuadradas de sus densidades o a las raíces cuadradas de las masas de sus átomos/moléculas (Ley de Graham).,
ecuaciones clave
química ejercicios de fin de capítulo
- Se encuentra que un globo lleno de gas helio tarda 6 horas en desinflarse al 50% de su volumen original. ¿Cuánto tiempo tomará para que un globo idéntico lleno con el mismo volumen de gas hidrógeno (en lugar de helio) disminuya su volumen en un 50%?
- explicar por qué los números de moléculas no son idénticos en las bombillas de mano izquierda y derecha que se muestran en la ilustración central de la Figura 1.,
- comenzando con la definición de tasa de derrame y el hallazgo de Graham relacionando la tasa y la masa molar, muestran cómo derivar la ecuación de la Ley de Graham, relacionando las tasas relativas de derrame para dos gases con sus masas moleculares.
- El agua pesada, D2O (masa molar = 20.03 g mol-1), se puede separar del agua ordinaria, H2O (masa molar = 18.01), como resultado de la diferencia en las tasas relativas de difusión de las moléculas en la fase gaseosa. Calcule las tasas relativas de difusión de H2O y D2O.
- ¿Cuál de los siguientes gases difunde más lentamente que el oxígeno?, F2, Ne, N2O, C2H2, NO, Cl2, H2S
- Durante la discusión de la difusión gaseosa para enriquecer uranio, se afirmó que
235uf6 difunde 0,4% más rápido que 238uf6. Muestra el cálculo que admite este valor. La masa molar de 235UF6 = 235.043930 + 6 × 18.998403 = 349.034348 g/mol y la masa molar de 238UF6 = 238.050788 + 6 × 18.998403 = 352.041206 g/mol. - calcular la tasa relativa de difusión de 1H2 (masa molar 2.0 g/mol) en comparación con la de 2H2 (masa molar 4.,0 g / mol) y la tasa relativa de difusión de O2 (masa molar 32 g/mol) en comparación con la de O3 (masa molar 48 g/mol).
- Un gas de identidad desconocida se difunde a una velocidad de 83,3 mL/s en un aparato de difusión en el que el dióxido de carbono se difunde a una velocidad de 102 mL/S. calcule la masa molecular del gas desconocido.
- Cuando dos tapones de algodón, uno humedecido con amoníaco y el otro con ácido clorhídrico, se insertan simultáneamente en los extremos opuestos de un tubo de vidrio que mide 87,0 cm de largo, se forma un anillo blanco de NH4Cl donde el NH3 gaseoso y el HCl gaseoso entran en contacto por primera vez., (Sugerencia: Calcule las tasas de difusión para NH3 y HCl, y averigüe cuánto más rápido difunde NH3 que HCl.) \text{NH}_3 (g) + \text{HCl}(g) \longrightarrow \text{NH}_4 \text{Cl}(S)
aproximadamente ¿a qué distancia del tapón humedecido con amoníaco ocurre esto?,m o molécula de una región de concentración relativamente alta a una de concentración relativamente baja (discutida en este capítulo con respecto a especies gaseosas, pero aplicable a especies en cualquier fase) efusión transferencia de átomos o moléculas gaseosas desde un contenedor a un vacío a través de aberturas muy pequeñas Ley de Graham de efusión las tasas de difusión y efusión de gases son inversamente proporcionales a las raíces cuadradas de sus masas moleculares trayectoria libre media distancia promedio que una molécula viaja entre colisiones tasa de difusión cantidad de gas que se difunde a través de un área dada durante un tiempo dado

Deja una respuesta