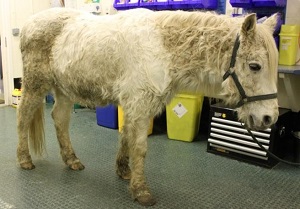
Poney avec hypertrichose. Crédit d’Image: Edd Knowles
malgré son nom couramment utilisé de la maladie de Cushing équine, les aspects les plus intéressants de la dysfonction pars intermedia hypophysaire équine (PPID) sont, en fait, ses dissemblances du syndrome de Cushing, chez les humains ou les chiens., Comme le suggère le nom recommandé PPID, il s’agit d’une maladie affectant la pars intermedia de l’hypophyse, pas la pars distalis ou la glande surrénale. Cela a des répercussions sur les meilleurs moyens de diagnostiquer et de traiter la maladie.
physiopathologie sous-jacente
de nombreux aspects de la physiopathologie de ce trouble sont encore inconnus. Cependant, les bases sont relativement incontestées. C’est une maladie neurodégénérative affectant les neurones dopaminergiques périventriculaires de l’hypothalamus.,1,2 la perte de dopamine dans le lobe intermédiaire de l’hypophyse empêche les effets inhibiteurs de la stimulation des récepteurs dopaminergiques D2 dans les membranes cellulaires des mélanotrophes.
en santé, cette inhibition entraîne une diminution de la synthèse et de la libération des peptides dérivés de pars intermedia pro-opiomelanocortin (POMC) et une diminution de la prolifération des mélanotrophes., La perte d’inhibition médiée par la dopamine entraîne initialement une hypertrophie et une hyperplasie du lobe intermédiaire, avec une augmentation de l’hormone stimulante α-mélanocytaire circulante (α-MSH), de l’adrénocorticotrophine (ACTH), de la β-endorphine et du peptide intermédiaire de type corticotrophine (CLIP).3 avec la progression de la maladie, le pars intermedia s’agrandit davantage, formant un adénome qui peut comprimer les structures hypophysaires, hypothalamiques et cérébrales adjacentes.4
la cause de la dégénérescence des nerfs contenant de la dopamine est encore inconnue., Il existe des preuves d’accumulation de marqueurs de stress oxydant2,de protéines terminales nerveuses mal repliées2 et peut-être d’une clairance protéique altérée5,mais la question de savoir s’il s’agit de causes ou de conséquences de la maladie n’est pas encore prouvée.
difficultés de diagnostic
Le diagnostic de PPID peut être difficile et controversé. Comme pour de nombreuses maladies évolutives, l’identification des cas avancés est simple, mais celle des cas précoces est plus difficile.,
‘les aspects les plus intéressants du PPID équin sont, en fait, ses différences avec le syndrome de Cushing’
une complication supplémentaire spécifique aux équidés est liée à leur adaptation à la survie dans les climats tempérés. Les chevaux, et en particulier les poneys, ont la capacité de réguler leur métabolisme pour stocker de l’énergie lorsque les nutriments sont facilement disponibles au printemps et en été, en prévision de l’automne et de l’hiver lorsque les nutriments sont rares., Les changements de température saisonniers entraînent la croissance d’un long manteau de cheveux en hiver qui est perdu au printemps. Le pars intermedia est impliqué dans ces changements saisonniers, comme en témoignent les variations saisonnières des concentrations D’ACTH et de MSH,la réponse du cortisol à la suppression de la dexaméthasone7 et la réponse de L’ACTH à la stimulation de l’hormone libérant la thyrotrophine (TRH).,8,9
Les études portant sur les méthodes de diagnostic sont souvent entravées par l’absence de test ante-mortem « étalon-or », et les études utilisant le diagnostic post-mortem peuvent également être imparfaites en raison des variations saisonnières de l’aspect histologique de l’intermédiaire pars10 et des incohérences dans les diagnostics histologiques entre pathologistes.11 des progrès récents dans le diagnostic post-mortem ont été réalisés;12 l’utilisation de ces méthodes peut permettre d’approfondir les tests ante-mortem., Le seul test qui n’a pas de faux positifs est la présence d’hypertrichose, un signe clinique pathognomonique présent aux stades les plus avancés de la maladie.
Les recommandations actuelles pour le diagnostic sont basées sur un algorithme conçu par le groupe D’Endocrinologie équine.13 chez les animaux présentant des signes cliniques évidents de PPID, l’ACTH au repos est le test de première intention. Si cette valeur est élevée, par rapport à la fourchette de référence corrigée des variations saisonnières,14,15, le traitement doit être instauré., Si l’ACTH au repos est normale et chez les animaux présentant des signes subtils de PPID, le test de stimulation de la TRH doit être effectué et l’ACTH mesurée.16 une réponse exagérée est observée chez les personnes touchées par PPID.
La Laminite a longtemps été liée au PPID. La théorie actuelle est que l’hyperinsulinémie est le principal facteur de risque de laminite, et PPID peut être un facteur de risque d’hyperinsulinémie. Le test actuellement recommandé pour le risque d’hyperinsulinémie cliniquement significative est la mesure de la réponse insulinique au sucre oral., Si une réponse exagérée est observée, une gestion visant à réduire l’accès aux pâturages et des niveaux élevés d’aliments glucidiques non structuraux est nécessaire.
approches thérapeutiques
le traitement a varié au fil des ans mais, depuis l’Autorisation du mésylate de pergolide pour une utilisation dans le PPID chez le cheval en 2011 (Prascend®; Boehringer Ingelheim Vetmedica), les alternatives de la cyproheptadine (un antagoniste de la sérotonine) et du trilostane (un inhibiteur de la stéroïdogenèse surrénalienne) sont rarement utilisées.,
Le Pergolide est un agoniste des récepteurs de la dopamine, agissant pour restaurer l’inhibition médiée par les récepteurs de la dopamine des mélanotrophes du pars intermedia. Le traitement par le pergolide réduit les concentrations basales17 D’ACTH et améliore les signes cliniques dans la majorité des cas, l’effet secondaire le plus fréquent étant l’inappétence.18,19 si le pergolide n’entraîne pas une amélioration suffisante, le traitement par la cyproheptadine peut être testé.
amélioration du pronostic
bien que le traitement puisse améliorer les signes cliniques et la qualité de vie des chevaux atteints de PPID, la maladie ne peut être prise en charge et non guérie., La maladie affecte les animaux d’âge moyen à plus âgés, avec des degrés variables des signes cliniques suivants: hypertrichose, transpiration anormale, prédisposition à la laminite et/ou aux infections, perte de masse musculaire, léthargie, polyurie et polydipsie.20 la combinaison d’une prise en charge pharmacologique efficace et d’une prise en charge de soutien peut, de manière anecdotique, conduire à une amélioration de la qualité de vie pendant plusieurs années, bien que les études contrôlées randomisées manquent dans ce domaine.,
Le PPID équin présente peu de similitudes avec le syndrome de Cushing humain ou canin; la reconnaissance des différences entre les conditions a facilité les progrès dans les domaines difficiles de la compréhension de la physiopathologie du PPID équin et de la meilleure façon de le diagnostiquer.
Elizabeth Finding
démonstratrice D’Anatomie, Royal Veterinary College, Londres
- McFarlane D 2007 Ageing Research Reviews 6 54-63.
- McFarlane D et coll. 2005 Journal de neuroendocrinologie 17 73-80.
- Orth DN et coll. 1982 Endocrinologie 110 1430-1441.
- Boujon CE et al., 1993 Journal de pathologie comparée 109 163-178.
- McFarlane D et coll. 2011 Revue de Médecine Interne Vétérinaire 25 750 Abst 85B.
- Hêtre J et coll. 2009 Journal de L’American Veterinary Medical Association 235 715-722.
- Donaldson MT et coll. 2005 Revue de Médecine Interne Vétérinaire 19 217-222.
- Diez de Castro E et coll. 2014 Endocrinologie Des Animaux Domestiques 48 77-83.
- Fredrick J et coll. 2014 Revue de Médecine Interne Vétérinaire 28 1104 Abst E-8.
- Cordero M et coll. 2012 le Journal de la Science Vétérinaire Équine 32 75-79.
- McFarlane D et coll., 2005 American Journal of Veterinary Research 66 2055-2059.
- Leitenbacher J & Herbach N 2016 Journal of Comparative de la Pathologie 154 215-224.
- Frank N et coll. 2015 recommandations pour le diagnostic et le traitement de PPID
- Copas VEN& Durham ae 2012 Equine Veterinary Journal 44 440-443.
- McGowan TW et coll. 2013 Equine Veterinary Journal 45 66-73.
- Hêtre J et coll. 2011 Journal de L’American Veterinary Medical Association 238 1305-1315.
- McFarlane D et coll., 2016 Journal de Vétérinaire, la Pharmacologie et de la Thérapeutique doi: 10.1111/jvp.12339.
- Donaldson MT et coll. 2002 Revue de Médecine Interne Vétérinaire 16 742-746.
- Perkins GA et coll. 2002 Equine Veterinary Journal 34 679-685.
- McFarlane D 2011 dans les Cliniques Vétérinaires d’Amérique du Nord: Hippique Pratique 27 93-113.

Laisser un commentaire