Obiettivi di Apprendimento
alla fine di questa sezione, si sarà in grado di:
- Definire e spiegare effusione e la diffusione
- Stato legge di Graham e utilizzarle per calcolare rilevanti proprietà dei gas
Se avete mai stato in una stanza quando una fumante pizza è stato consegnato, sono stati messi a conoscenza del fatto che le molecole gassose può diffondersi rapidamente in tutta una stanza, come evidenziato dal piacevole aroma che raggiunge presto il vostro naso., Anche se le molecole gassose viaggiano a velocità tremende (centinaia di metri al secondo), si scontrano con altre molecole gassose e viaggiano in molte direzioni diverse prima di raggiungere l’obiettivo desiderato. A temperatura ambiente, una molecola gassosa sperimenterà miliardi di collisioni al secondo. Il percorso libero medio è la distanza media percorsa da una molecola tra le collisioni., Il libero cammino medio aumenta con la diminuzione della pressione; in generale, il cammino libero medio di una molecola gassosa sarà centinaia di volte il diametro della molecola
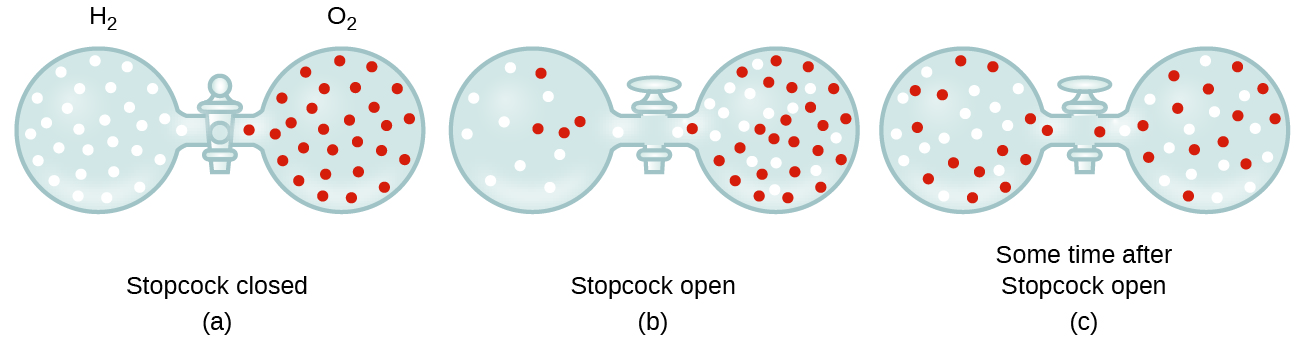
In generale, sappiamo che quando un campione di gas è stato introdotto per una parte di un contenitore chiuso, le sue molecole molto rapidamente disperse in tutto il contenitore; questo processo mediante il quale le molecole disperse nello spazio, in risposta alle differenze di concentrazione è chiamato diffusione (Figura 1)., Gli atomi gassosi o le molecole sono, naturalmente, inconsapevoli di qualsiasi gradiente di concentrazione, si muovono semplicemente in modo casuale-le regioni di concentrazione più elevata hanno più particelle rispetto alle regioni di concentrazioni più basse, e quindi avviene un movimento netto di specie da aree di concentrazione alta a bassa. In un ambiente chiuso, la diffusione si tradurrà in concentrazioni uguali di gas in tutto, come illustrato nella Figura 1., Gli atomi gassosi e le molecole continuano a muoversi, ma poiché le loro concentrazioni sono le stesse in entrambi i bulbi, le velocità di trasferimento tra i bulbi sono uguali (non si verifica alcun trasferimento netto di molecole).
Ci sono spesso interessati il tasso di diffusione, la quantità di gas che passa attraverso alcuni di superficie per unità di tempo:
La velocità di diffusione dipende da diversi fattori: il gradiente di concentrazione (l’aumento o il calo di concentrazione da un punto ad un altro); la quantità di superficie disponibile per la diffusione; e la distanza delle particelle di gas deve viaggiare., Si noti inoltre che il tempo necessario per la diffusione è inversamente proporzionale alla velocità di diffusione, come mostrato nell’equazione della velocità di diffusione.
Un processo che coinvolge il movimento di specie gassose simile alla diffusione è l’effusione, la fuga di molecole di gas attraverso un piccolo foro come un foro stenopeico in un palloncino nel vuoto (Figura 2). Sebbene i tassi di diffusione e di effusione dipendano entrambi dalla massa molare del gas coinvolto, i loro tassi non sono uguali; tuttavia, i rapporti dei loro tassi sono gli stessi.,
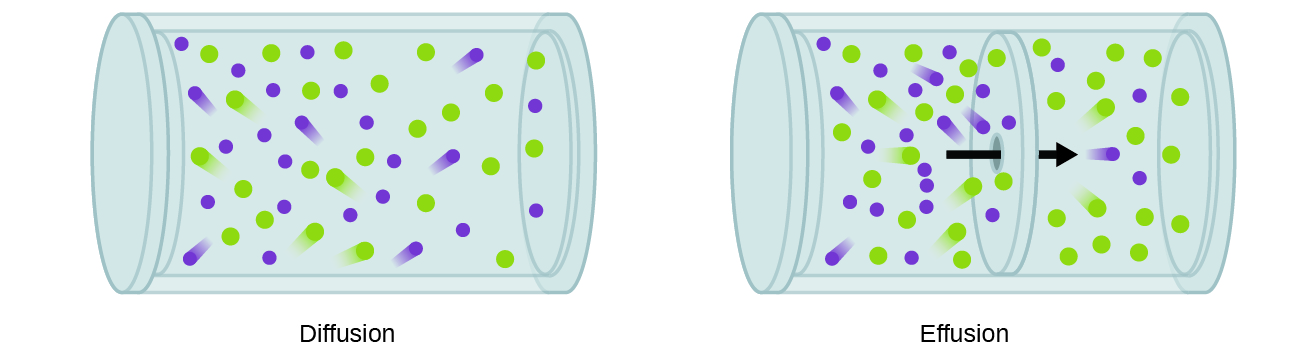
Se una miscela di gas viene posta in un contenitore con pareti porose, i gas effusero attraverso le piccole aperture nelle pareti. I gas più leggeri passano attraverso le piccole aperture più rapidamente (ad una velocità superiore) rispetto a quelli più pesanti (Figura 3).,particelle:
Questo significa che se due gas A e B sono alla stessa temperatura e pressione, il loro rapporto di effusione costo è inversamente proporzionale al rapporto tra la radice quadrata della massa delle loro particelle:

Ecco un altro esempio, facendo il punto su come determinare i tempi differisce dalla determinazione dei tassi.,
Infine, ecco un altro esempio che mostra come calcolare la massa molare dai dati del tasso di effusione.
Uso della diffusione per applicazioni energetiche nucleari: Arricchimento dell’uranio
La diffusione gassosa è stata utilizzata per produrre uranio arricchito per l’uso in centrali nucleari e armi. L’uranio naturale contiene solo lo 0,72% di 235U, il tipo di uranio “fissile”, cioè in grado di sostenere una reazione a catena di fissione nucleare. Reattori nucleari richiedono combustibile che è 2-5% 235U, e bombe nucleari hanno bisogno di concentrazioni ancora più elevate., Un modo per arricchire l’uranio ai livelli desiderati è quello di approfittare della legge di Graham. In un impianto di arricchimento a diffusione gassosa, l’esafluoruro di uranio (UF6, l’unico composto di uranio che è abbastanza volatile da funzionare) viene lentamente pompato attraverso grandi vasi cilindrici chiamati diffusori, che contengono barriere porose con aperture microscopiche. Il processo è uno di diffusione perché l’altro lato della barriera non viene evacuato. Le molecole 235UF6 hanno una velocità media più elevata e si diffondono attraverso la barriera un po ‘ più velocemente delle molecole 238UF6 più pesanti., Il gas che ha attraversato la barriera è leggermente arricchito in 235UF6 e il gas residuo è leggermente esaurito. La piccola differenza di peso molecolare tra 235UF6 e 238UF6 solo circa 0,4% di arricchimento, si ottiene in un diffusore (Figura 4). Ma collegando molti diffusori in una sequenza di fasi (chiamata cascata), è possibile raggiungere il livello desiderato di arricchimento.
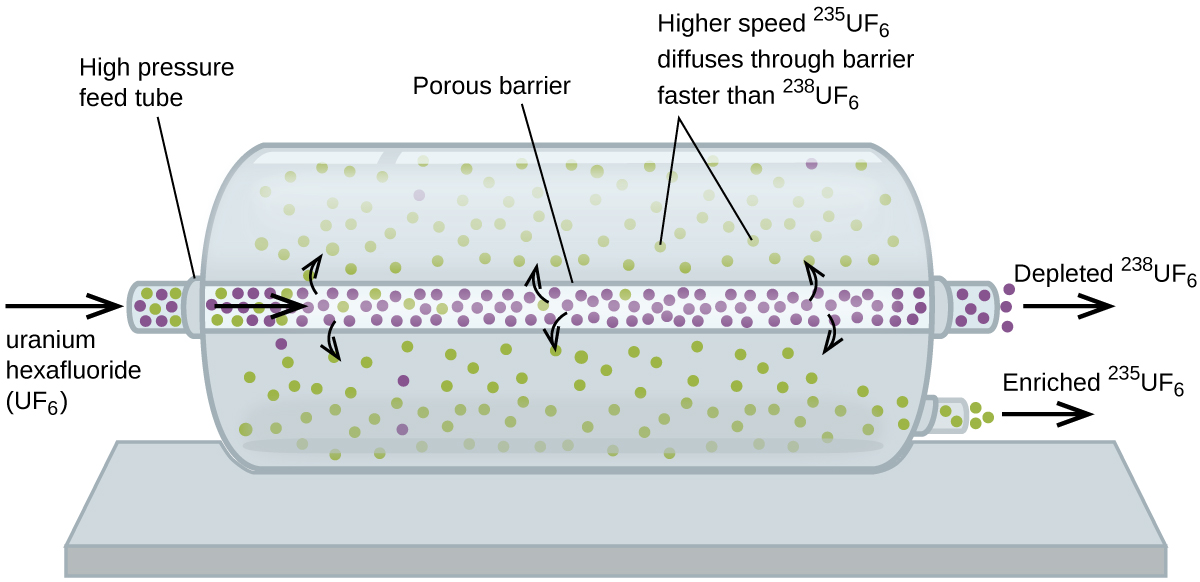
la grande scala, La separazione di gas 235UF6 da 238UF6 è stato fatto per la prima volta durante la seconda Guerra Mondiale, all’energia atomica installazione a Oak Ridge, Tennessee, come parte del Progetto Manhattan (lo sviluppo della prima bomba atomica)., Anche se la teoria è semplice, ciò ha richiesto il superamento di molte sfide tecniche scoraggianti per farlo funzionare nella pratica. La barriera deve avere fori minuscoli e uniformi (circa 10-6 cm di diametro) ed essere abbastanza porosa da produrre portate elevate. Tutti i materiali (barriera, tubi, rivestimenti superficiali, lubrificanti e guarnizioni) devono essere in grado di contenere, ma non reagire con, l’UF6 altamente reattivo e corrosivo.,
Poiché gli impianti di diffusione gassosa richiedono grandi quantità di energia (per comprimere il gas alle alte pressioni richieste e guidarlo attraverso la cascata del diffusore, per rimuovere il calore prodotto durante la compressione e così via), ora viene sostituito dalla tecnologia della centrifuga a gas, che richiede molta meno energia. Un tema politico caldo attuale è come negare questa tecnologia all’Iran, per impedirgli di produrre abbastanza uranio arricchito da poter utilizzare per fabbricare armi nucleari.
Atomi e molecole gassose si muovono liberamente e casualmente nello spazio., La diffusione è il processo per cui gli atomi gassosi e le molecole vengono trasferiti da regioni di concentrazione relativamente alta a regioni di concentrazione relativamente bassa. L’effusione è un processo simile in cui le specie gassose passano da un contenitore a un vuoto attraverso orifizi molto piccoli. I tassi di effusione dei gas sono inversamente proporzionali alle radici quadrate delle loro densità o alle radici quadrate delle masse dei loro atomi/molecole (legge di Graham).,
Equazioni chiave
Chimica Esercizi di fine capitolo
- Un palloncino pieno di gas elio impiega 6 ore per sgonfiarsi al 50% del suo volume originale. Quanto tempo ci vorrà per un palloncino identico riempito con lo stesso volume di gas idrogeno (invece di elio) per diminuire il suo volume del 50%?
- Spiegare perché i numeri di molecole non sono identici nelle lampadine sinistra e destra mostrate nell’illustrazione centrale della Figura 1.,
- Partendo dalla definizione di tasso di effusione e dalla scoperta di Graham relativa alla velocità e alla massa molare, mostra come derivare l’equazione della legge di Graham, mettendo in relazione i tassi relativi di effusione per due gas con le loro masse molecolari.
- L’acqua pesante, D2O (massa molare = 20,03 g mol–1), può essere separata dall’acqua ordinaria, H2O (massa molare = 18,01), come risultato della differenza nei tassi relativi di diffusione delle molecole nella fase gassosa. Calcola i tassi relativi di diffusione di H2O e D2O.
- Quale dei seguenti gas si diffonde più lentamente dell’ossigeno?, F2, Ne, N2O, C2H2, NO, Cl2, H2S
- Durante la discussione sulla diffusione gassosa per l’arricchimento dell’uranio, è stato affermato che
235UF6 diffonde lo 0,4% più velocemente di 238UF6. Mostra il calcolo che supporta questo valore. La massa molare di 235UF6 = 235.043930 + 6 × 18.998403 = 349.034348 g / mol e la massa molare di 238UF6 = 238.050788 + 6 × 18.998403 = 352.041206 g / mol. - Calcolare la velocità relativa di diffusione di 1H2 (massa molare 2,0 g/mol) rispetto a quella di 2H2 (massa molare 4.,0 g/mol) e la relativa velocità di diffusione di O2 (massa molare 32 g/mol) rispetto a quella di O3 (massa molare 48 g/mol).
- Un gas di identità sconosciuta si diffonde ad una velocità di 83,3 mL/s in un apparato di diffusione in cui l’anidride carbonica si diffonde alla velocità di 102 mL / s. Calcolare la massa molecolare del gas sconosciuto.
- Quando due tappi di cotone, uno inumidito con ammoniaca e l’altro con acido cloridrico, vengono contemporaneamente inseriti nelle estremità opposte di un tubo di vetro lungo 87,0 cm, si forma un anello bianco di NH4Cl dove prima entrano in contatto NH3 gassoso e HCl gassoso., (Suggerimento: Calcolare i tassi di diffusione sia per NH3 e HCl, e scoprire quanto più veloce NH3 diffonde di HCl.) \ text {NH}_3 (g) + \ text {HCl} (g) \longrightarrow \text{NH}_4 \ text{Cl}(s)
A circa quale distanza dal tappo inumidito con ammoniaca si verifica?,m o molecola da una regione relativamente alta concentrazione di uno di concentrazione relativamente bassa (discusso in questo capitolo per quanto riguarda gassosi specie, ma applicabile alla specie in qualunque fase) effusione di trasferimento dei gas di atomi o di molecole da un contenitore a un vuoto attraverso piccole fessure legge di Graham di effusione tassi di diffusione ed effusione dei gas sono inversamente proporzionali alle radici quadrate dei loro masse molecolari cammino libero medio distanza media di una molecola di viaggi tra collisioni tasso di diffusione quantità di gas che si diffondono attraverso una determinata area in un dato periodo di tempo

Lascia un commento