Objetivos
Ao final desta seção, você será capaz de:
- Definir e explicar efusão e difusão
- Estado lei de Graham e usá-lo para calcular relevantes propriedades de gás
Se você já foi em um quarto, quando uma tubulação quente pizza foi entregue, você está ciente do fato de que moléculas gasosas podem rapidamente se espalhou por toda a sala, como evidenciado por um agradável aroma que logo alcança o seu nariz., Embora as moléculas gasosas viajem a tremendas velocidades (centenas de metros por segundo), elas colidem com outras moléculas gasosas e viajam em muitas direções diferentes antes de atingir o alvo desejado. À temperatura ambiente, uma molécula gasosa experimentará bilhões de colisões por segundo. O caminho livre médio é a distância média que uma molécula percorre entre colisões., O caminho livre médio aumenta com a diminuição da pressão; em geral, o caminho livre médio para o gasoso molécula vai ser centenas de vezes maior que o diâmetro da molécula
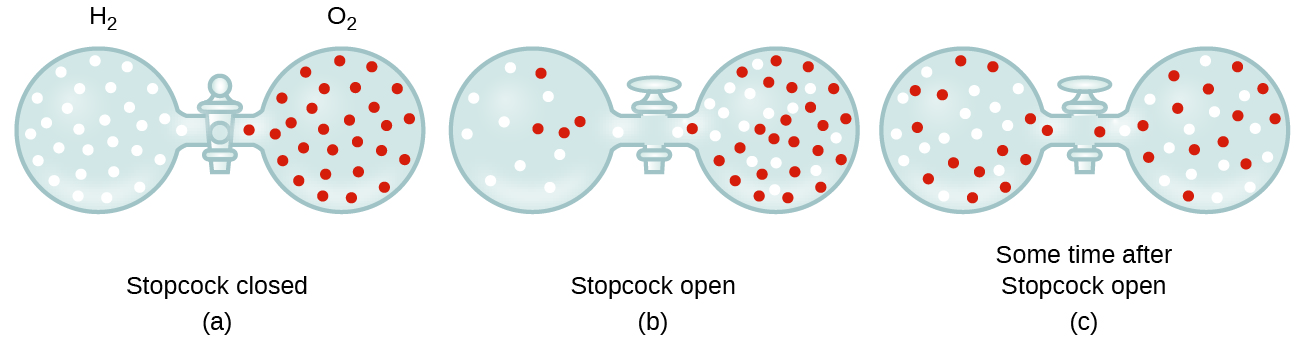
Em geral, sabemos que quando uma amostra de gás é introduzido a uma parte de um recipiente fechado, suas moléculas muito rapidamente se dispersar por todo o recipiente; este processo pelo qual moléculas de dispersar no espaço, em resposta às diferenças de concentração é chamado difusão (mostrado na Figura 1)., Os átomos ou moléculas gasosos são, naturalmente, inconscientes de qualquer gradiente de concentração, eles simplesmente se movem aleatoriamente—regiões de maior concentração têm mais partículas do que regiões de menor concentração, e assim um movimento líquido de espécies de áreas de alta para baixa concentração ocorre. Num ambiente fechado, a difusão resultará, em última análise, em concentrações iguais de gás por todo o lado, como descrito na Figura 1., Os átomos e moléculas gasosas continuam a se mover, mas como suas concentrações são as mesmas em ambas as lâmpadas, as taxas de transferência entre as lâmpadas são iguais (nenhuma transferência líquida de moléculas ocorre).
Estamos muitas vezes interessados em que a taxa de difusão, a quantidade de gás que passa através da área por unidade de tempo:
A taxa de difusão depende de vários fatores: o gradiente de concentração (aumento ou diminuição da concentração de um ponto a outro); a quantidade de área de superfície disponível para a difusão; e a distância que as partículas de gás deve viajar., Note também que o tempo necessário para a difusão ocorrer é inversamente proporcional à taxa de difusão, como mostrado na equação de difusão.um processo que envolve o movimento de espécies gasosas semelhantes à difusão é a efusão, a fuga de moléculas de gás através de um buraco minúsculo, como um buraco no balão para um vácuo (Figura 2). Embora as taxas de difusão e efusão dependam tanto da massa molar do gás envolvido, suas taxas não são iguais; no entanto, as razões de suas taxas são as mesmas.,
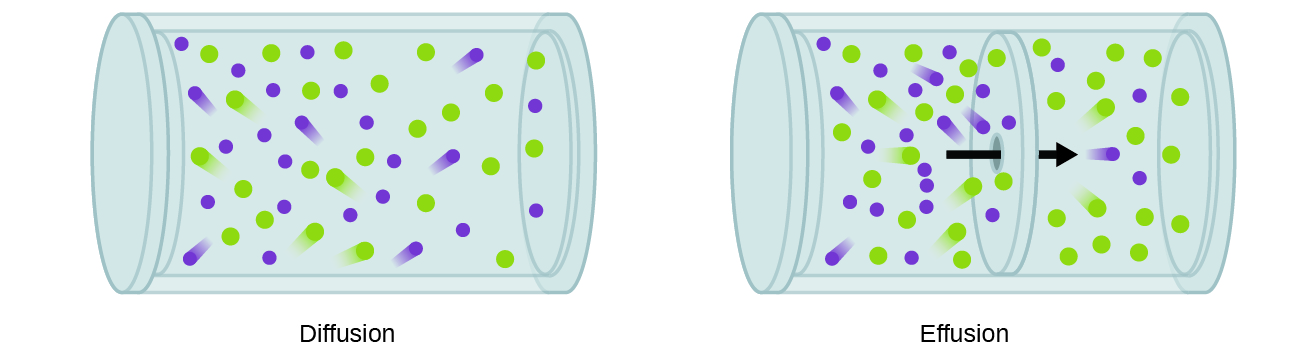
Se uma mistura de gases é colocado em um recipiente com paredes porosas, os gases effuse através de pequenas aberturas nas paredes. Os gases mais leves passam pelas pequenas aberturas mais rapidamente (a uma taxa mais elevada) do que os mais pesados (Figura 3).,partículas:
Isto significa que, se dois gases A e B estão na mesma temperatura e pressão, a relação entre as suas derrame taxas é inversamente proporcional à relação entre as raízes quadradas das massas de suas partículas:

Aqui está outro exemplo, fazendo o ponto sobre como a determinação dos tempos difere da determinação das taxas.,
finalmente, aqui está mais um exemplo mostrando como calcular a massa molar a partir dos dados da taxa de efusão.
Utilização da difusão para aplicações de energia Nuclear: enriquecimento de urânio
difusão gasosa tem sido utilizada para produzir urânio enriquecido para utilização em centrais nucleares e armas. Urânio natural contém apenas 0,72% de 235U, o tipo de urânio que é “físsil”, ou seja, capaz de sustentar uma reação em cadeia de fissão nuclear. Os reactores nucleares necessitam de combustível que seja de 2-5% 235U, e as bombas nucleares precisam de concentrações ainda mais elevadas., Uma maneira de enriquecer urânio para os níveis desejados é aproveitar a lei de Graham. Em uma fábrica de enriquecimento de difusão gasosa, o hexafluoreto de urânio (UF6, o único composto de urânio que é volátil o suficiente para funcionar) é lentamente bombeado através de grandes recipientes cilíndricos chamados difusores, que contêm barreiras porosas com aberturas microscópicas. O processo é de difusão porque o outro lado da barreira não é evacuado. As 235UF6 têm uma velocidade média mais elevada e se difunde através da barreira um pouco mais rápido do que as 238UF6 mais pesadas., O gás que passou pela barreira é ligeiramente enriquecido em 235UF6 e o gás residual está ligeiramente esgotado. A pequena diferença de pesos moleculares entre 235UF6 e 238UF6 apenas é alcançada em cerca de 0, 4% de enriquecimento ,num difusor (Figura 4). Mas ao conectar muitos difusores em uma sequência de etapas (chamada cascata), o nível desejado de enriquecimento pode ser alcançado.
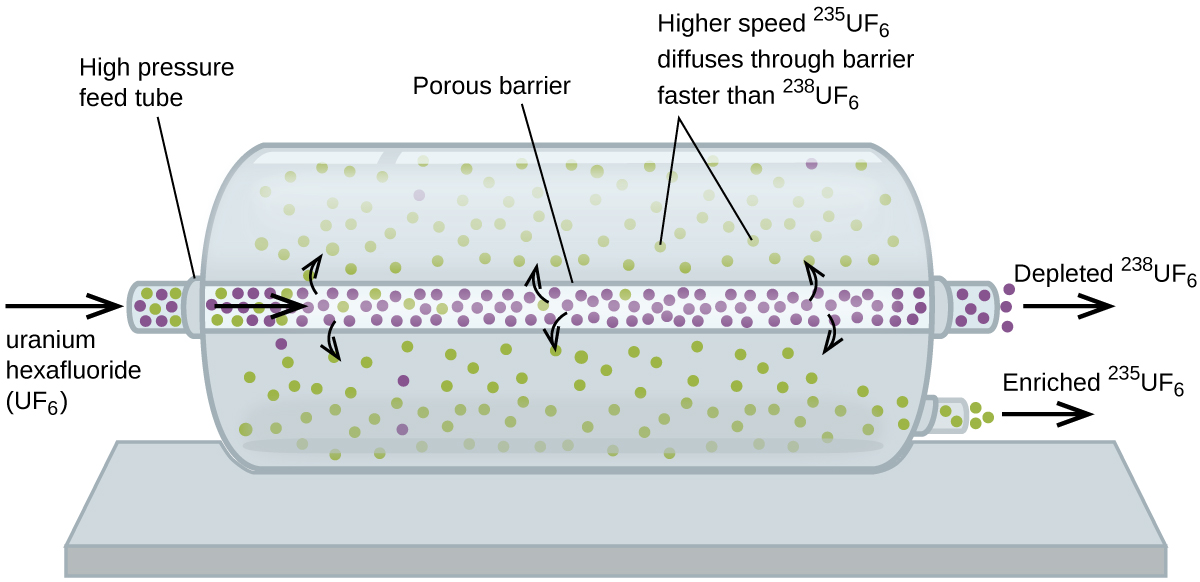
O grande escala separação de gases 235UF6 de 238UF6 foi feito pela primeira vez durante a segunda Guerra Mundial, a energia atômica instalação em Oak Ridge, no Tennessee, como parte do Projeto Manhattan (o desenvolvimento da primeira bomba atômica)., Embora a teoria seja simples, isso exigiu superar muitos desafios técnicos assustadores para fazê-la funcionar na prática. A barreira deve ter furos minúsculos e uniformes (cerca de 10-6 cm de diâmetro) e ser porosa o suficiente para produzir altas taxas de fluxo. Todos os materiais (barreira, tubagem, revestimentos de superfície, lubrificantes e juntas) precisam ser capazes de conter, mas não reagir com, o UF6 altamente reativo e corrosivo.,
Devido a difusão gasosa plantas requerem grandes quantidades de energia (para comprimir o gás para altas pressões necessárias e conduzi-lo através do difusor em cascata, para remover o calor produzido durante a compressão, e assim por diante), é agora a ser substituído por gás tecnologia de centrifugação, que requer muito menos energia. Uma questão política actual é a de saber como negar esta tecnologia ao irão, para o impedir de produzir urânio enriquecido suficiente para que possam utilizar para fabricar armas nucleares.
átomos e moléculas gasosos movem-se livremente e aleatoriamente pelo espaço., Difusão é o processo pelo qual átomos e moléculas gasosos são transferidos de regiões de concentração relativamente alta para regiões de concentração relativamente baixa. Efusão é um processo similar no qual espécies gasosas passam de um recipiente para um vácuo através de orifícios muito pequenos. As taxas de efusão de gases são inversamente proporcionais às raízes quadradas de suas densidades ou às raízes quadradas de suas massas de átomos/moléculas (Lei de Graham).,um balão cheio de gás hélio leva 6 horas para se esvaziar até 50% do seu volume original. Quanto tempo demorará um balão idêntico cheio com o mesmo volume de hidrogénio (em vez de hélio) a diminuir o seu volume em 50%?
235UF6 difunde 0,4% mais rápido que 238UF6. Mostra o cálculo que suporta este valor. A massa molar de 235UF6 = 235.043930 + 6 × 18.998403 = 349.034348 g/mol e a massa molar de 238UF6 = 238.050788 + 6 × 18.998403 = 352.041206 g/mol.
de, aproximadamente, que a distância a partir da amônia umedecido plug que isso ocorre?,m ou molécula a partir de uma região de concentração relativamente elevada a uma relativamente baixa concentração (discutidos neste capítulo, com relação às espécies gasosas, mas aplicável à espécie, em qualquer fase) derrame a transferência de gases de átomos ou moléculas de um recipiente a vácuo através de aberturas muito pequenas lei de Graham de derrame taxas de difusão e efusão dos gases são inversamente proporcionais às raízes quadradas de suas massas moleculares caminho livre médio distância média de uma molécula de viagens entre colisões taxa de difusão quantidade de gás de difusão através de uma determinada área em um determinado tempo

Deixe uma resposta