Folosind valorile pKa pentru a prezice reacția Echilibre
Prin definiție, valoarea pKa ne spune măsura în care un acid reacționează cu apa ca bază, dar, prin extensie, putem, de asemenea, calcula constanta de echilibru pentru o reacție între orice acido-bazic pereche., Din punct de vedere matematic, se poate demonstra că:
Keq (pentru bază de acid reacție în cauză) = 10ΔpKa
unde \(ΔpK_a\) este \(pK_a\) de produs acid minus \(pK_a\) de reactiv acid
luați în Considerare un reacției dintre metilamină și acidul acetic:
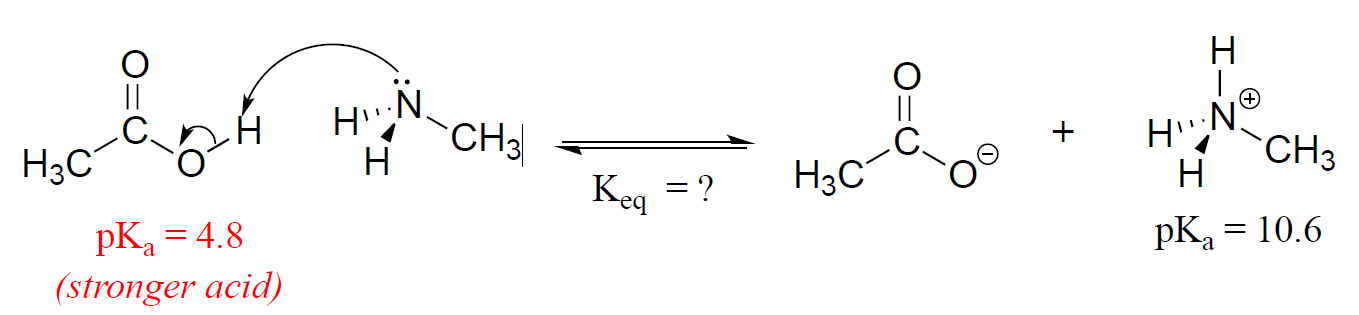
în Primul rând, avem nevoie pentru a identifica acid specii de pe ambele părți ale ecuației. Pe partea stângă, acidul este, desigur, acid acetic, în timp ce pe partea dreaptă acidul este metil amoniu., Valorile pKa specifice pentru acești acizi nu se află pe tabelul nostru pKa foarte generalizat, dar sunt date în figura de mai sus. Fără a efectua calcule, ar trebui să puteți vedea că acest echilibru se află departe de partea dreaptă: acidul acetic are un pKa mai mic, este un acid mai puternic și astfel vrea să renunțe la protonul său mai mult decât metil amoniu., Făcând matematica, vedem că
\
Dacă ați fi vrut doar să aproximați un răspuns fără a vă deranja să căutați un calculator, ați fi putut observa că diferența valorilor pKa este de aproximativ 6, deci constanta de echilibru ar trebui să fie undeva în ordinea 106 sau un milion. Folosind pKa masă, în acest fel, și de a face funcțional pe bază de grup pKa aproximări pentru molecule pentru care nu avem valori exacte, putem estima cu ușurință măsura în care o anumită reacție acido-bazic va continua.,
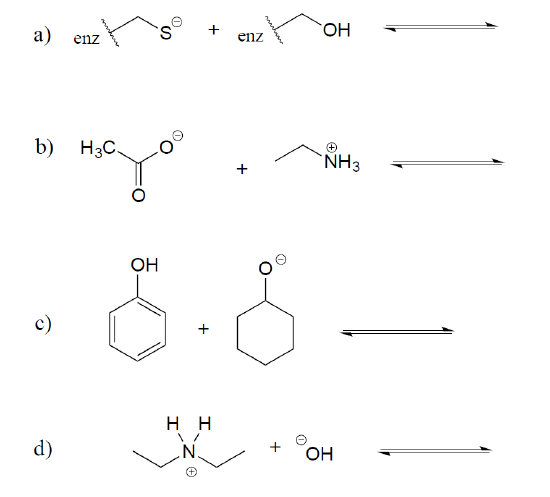
exemplu \(\PageIndex{1}\)
afișați produsele următoarelor reacții acido-bazice și estimați valoarea Keq. Utilizați tabelul pKa din secțiunea 2.8 și / sau din tabelele de referință.
Răspuns 

Lasă un răspuns