Obiectivele de Învățare
Până la sfârșitul acestei secțiuni, veți fi capabili să:
- Defini și explica de efuziune și de difuzie
- Starea lui Graham lege și să-l utilizați pentru a calcula relevante de gaze proprietăți
Dacă ați fost vreodată într-o cameră atunci când o fierbinte pizza a fost livrat, ați fost conștienți de faptul că gazoasă moleculele pot sa răspândit rapid în întreaga cameră, după cum reiese din aromă plăcută că, în curând ajunge la nas., Deși moleculele gazoase călătoresc cu viteze extraordinare (sute de metri pe secundă), ele se ciocnesc cu alte molecule gazoase și călătoresc în multe direcții diferite înainte de a atinge ținta dorită. La temperatura camerei, o moleculă gazoasă va experimenta miliarde de coliziuni pe secundă. Calea liberă medie este distanța medie pe care o moleculă o parcurge între coliziuni., Care înseamnă cale liberă crește cu scăderea presiunii; în general, înseamnă cale liberă pentru o moleculă gazoasă va fi de sute de ori diametrul moleculei
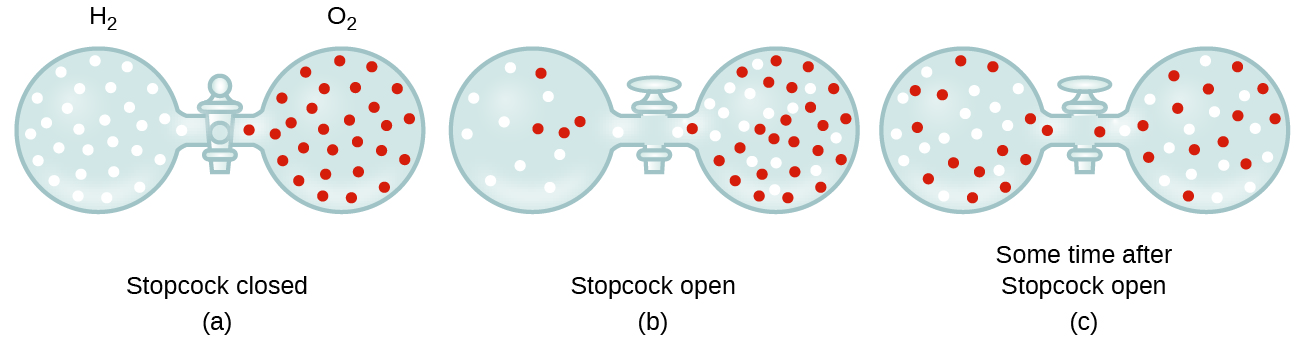
În general, știm că atunci când o probă de gaz este introdus la o parte de-un recipient închis, moleculele sale foarte dispersa rapid de-a lungul containerului; acest proces prin care moleculele dispersa în spațiu, ca răspuns la diferențele de concentrație se numește difuzie (prezentată în Figura 1)., Atomii gazoși sau moleculele sunt, desigur, conștienți de orice gradient de concentrație, ei pur și simplu muta aleatoriu—regiuni de concentrație mai mare au mai multe particule decât regiuni de concentrații mai mici, și astfel o mișcare netă de specii de la mare la zonele de concentrație scăzută are loc. Într-un mediu închis, difuzia va duce în cele din urmă la concentrații egale de gaz pe tot parcursul, așa cum este descris în Figura 1., Atomii și moleculele gazoase continuă să se miște, dar deoarece concentrațiile lor sunt aceleași în ambele becuri, ratele de transfer între becuri sunt egale (nu are loc transferul net de molecule).
Ne sunt de multe ori interesați de rata de difuzie, cantitatea de gaz care trece prin zonă pe unitatea de timp:
viteza De difuzie depinde de mai mulți factori: gradient de concentrație (de creștere sau scădere a concentrației de la un punct la altul); cantitatea de suprafața disponibilă pentru difuzie; și distanța gaz particule trebuie să călătorească., Rețineți, de asemenea, că timpul necesar difuziei este invers proporțional cu rata de difuzie, așa cum se arată în ecuația ratei de difuzie.
un proces care implică mișcarea speciilor gazoase similare difuziei este efuziunea, scăparea moleculelor de gaz printr-o gaură minusculă, cum ar fi un orificiu dintr-un balon într-un vid (Figura 2). Deși ratele de difuzie și efuziune depind atât de masa molară a gazului implicat, ratele lor nu sunt egale; cu toate acestea, rapoartele ratelor lor sunt aceleași.,
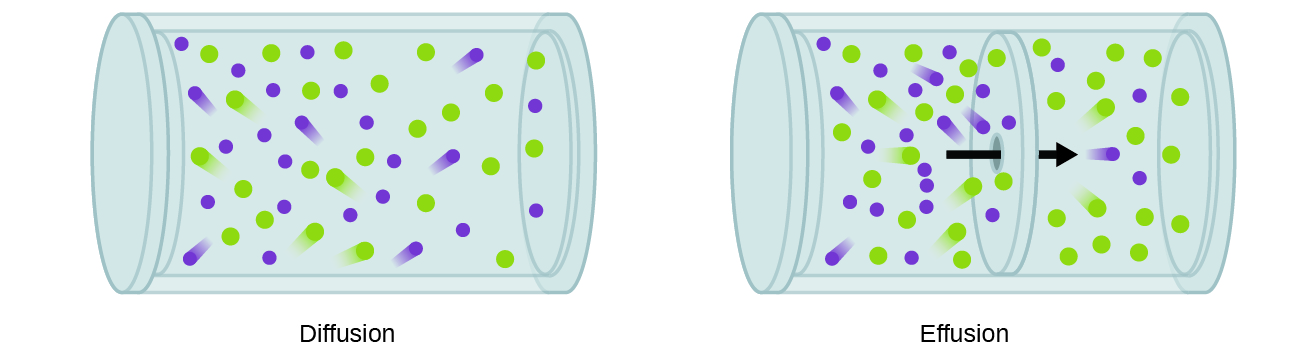
în Cazul unui amestec de gaze este plasat într-un recipient cu peretii poros, gazele effuse prin mici deschideri în pereți. Gazele mai ușoare trec prin orificiile mici mai rapid (cu o viteză mai mare) decât cele mai grele (Figura 3).,particule:
Acest lucru înseamnă că, dacă două gaze a și B sunt la aceeași temperatură și presiune, raportul lor efuziune rate este invers proporțională cu raportul dintre rădăcina pătrată a maselor particulelor lor:

Iată un alt exemplu, de a face punct cu privire la modul de determinare ori diferă de la stabilirea ratelor.,în sfârșit, iată încă un exemplu care arată cum se calculează masa molară din datele ratei de efuziune.
utilizarea difuziei pentru aplicații energetice nucleare: îmbogățirea uraniului
difuzia gazoasă a fost utilizată pentru a produce uraniu îmbogățit pentru utilizarea în centrale nucleare și arme. Uraniul natural conține doar 0,72% din 235U, tipul de uraniu care este „fisionabil”, adică capabil să susțină o reacție în lanț de fisiune nucleară. Reactoarele nucleare necesită combustibil care este de 2-5% 235U, iar bombele nucleare au nevoie de concentrații și mai mari., O modalitate de a îmbogăți uraniul la nivelurile dorite este de a profita de legea lui Graham. Într-o instalație de îmbogățire prin difuzie gazoasă, hexafluorura de uraniu (UF6, singurul compus de uraniu suficient de volatil pentru a funcționa) este pompată lent prin vase cilindrice mari numite difuzoare, care conțin bariere poroase cu deschideri microscopice. Procesul este unul de difuzie, deoarece cealaltă parte a barierei nu este evacuată. Moleculele 235uf6 au o viteză medie mai mare și difuzează prin barieră puțin mai repede decât moleculele 238uf6 mai grele., Gazul care a trecut prin barieră este ușor îmbogățit în 235uf6, iar gazul rezidual este ușor epuizat. Diferența mică în greutăți moleculare între 235uf6 și 238uf6 doar aproximativ 0,4% îmbogățire, se realizează într-un singur difuzor (Figura 4). Dar prin conectarea multor difuzoare într-o secvență de etape (numită cascadă), se poate atinge nivelul dorit de îmbogățire.
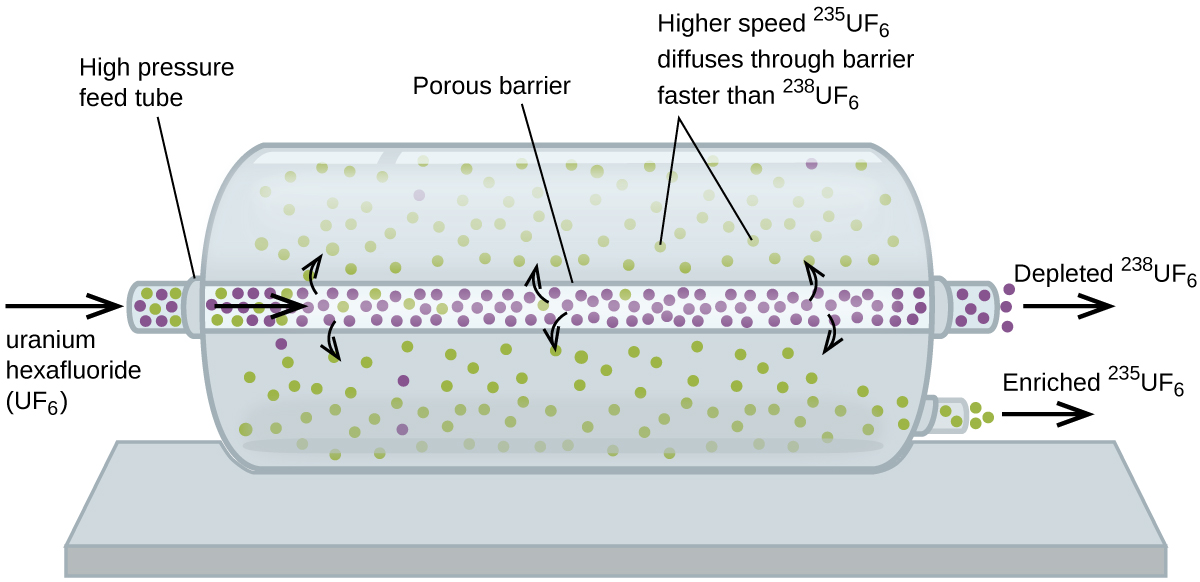
Pe scară largă de separare de gaze 235UF6 de 238UF6 fost făcută pentru prima dată în timpul al doilea Război Mondial, la energie atomică de instalare în Oak Ridge, Tennessee, ca parte a Proiectului Manhattan (dezvoltarea de prima bombă atomică)., Deși teoria este simplă, acest lucru a necesitat depășirea multor provocări tehnice descurajante pentru a face să funcționeze în practică. Bariera trebuie să aibă găuri mici, uniforme (aproximativ 10-6 cm în diametru) și să fie suficient de poroase pentru a produce debite mari. Toate materialele (bariera, tubulatura, acoperirile de suprafață, lubrifianții și garniturile) trebuie să poată conține, dar să nu reacționeze cu, UF6 foarte reactiv și coroziv.,deoarece instalațiile de difuzie gazoasă necesită cantități foarte mari de energie (pentru a comprima gazul la presiunile ridicate necesare și a-l conduce prin cascada difuzorului, pentru a îndepărta căldura produsă în timpul compresiei și așa mai departe), acum este înlocuită cu tehnologia de centrifugare a gazului, care necesită mult mai puțină energie. O problemă politică actuală este cum să negăm această tehnologie Iranului, pentru a-l împiedica să producă suficient uraniu îmbogățit pentru a le folosi pentru a face arme nucleare.atomii și moleculele gazoase se mișcă liber și aleatoriu prin spațiu., Difuzia este procesul prin care atomii și moleculele gazoase sunt transferate din regiuni cu concentrație relativ ridicată în regiuni cu concentrație relativ scăzută. Efuziunea este un proces similar în care speciile gazoase trec dintr-un recipient într-un vid prin orificii foarte mici. Ratele de efuziune a gazelor sunt invers proporționale cu rădăcinile pătrate ale densităților lor sau cu rădăcinile pătrate ale maselor atomilor/moleculelor lor (Legea lui Graham).,
ecuații cheie
Chimie sfârșitul capitolului exerciții
- un balon umplut cu gaz de heliu este găsit să ia 6 ore pentru a dezumfla la 50% din volumul său inițial. Cât timp va dura un balon identic umplut cu același volum de hidrogen gazos (în loc de heliu) pentru a-și reduce volumul cu 50%?
- explicați de ce numărul de molecule nu este identic în becurile din stânga și din dreapta prezentate în ilustrația centrală din Figura 1.,
- începând cu definiția ratei de efuziune și constatarea lui Graham referitoare la rata și masa molară, arată cum să derivăm ecuația Legii lui Graham, raportând ratele relative de efuziune pentru două gaze la masele lor moleculare.
- apei Grele D2O (masa molară = 20.03 g mol–1), pot fi separate din apă obișnuită, H2O (masa molară = 18.01), ca urmare a diferenței relative ratele de difuzie a moleculelor în faza de gaz. Calculați ratele relative de difuzie a H2O și D2O.
- care dintre următoarele gaze difuzează mai lent decât oxigenul?, F2, Ne, N2O, C2H2, NU, Cl2, H2S
- în Timpul discuției de difuzie gazoasă, pentru îmbogățirea uraniului, s-a susținut că
235UF6 difuzează cu 0,4% mai rapid decât 238UF6. Afișați calculul care acceptă această valoare. Masa molară a 235UF6 = 235.043930 + 6 × 18.998403 = 349.034348 g/mol și masa molară a 238UF6 = 238.050788 + 6 × 18.998403 = 352.041206 g/mol. - calculați rata relativă de difuzie a 1H2 (masa molară 2,0 g/mol) comparativ cu cea a 2H2 (masa molară 4.,0 g/mol) și rata relativă de difuzie a O2 (masa molară 32 g/mol) comparativ cu cea a O3 (masa molară 48 g/mol).
- un gaz de identitate necunoscută difuzează la o viteză de 83,3 mL/s într-un aparat de difuzie în care dioxidul de carbon difuzează la o viteză de 102 mL/s. calculați masa moleculară a gazului necunoscut.
- atunci Când două dopurile de vată, un umezită cu amoniac și alte cu acid clorhidric, sunt simultan introdus în capetele opuse ale unui tub de sticlă, care este 87.0 cm lungime, un inel alb de NH4Cl forme gazoase NH3 și HCl gazos intră prima în contact., (Sugestie: Calculați ratele de difuzie atât pentru NH3 cât și pentru HCl și aflați cât de repede difuzează NH3 decât HCl.)\text{NH}_3(g) + \text{HCl}(g) \longrightarrow \text{NH}_4 \text{Cl}(s)
aproximativ La ce distanta de la amoniac umezit plug se produce acest lucru?,m sau moleculă dintr-o regiune cu concentrație relativ ridicată la una cu concentrație relativ scăzută (discutată în acest capitol în ceea ce privește speciile gazoase, dar aplicabilă speciilor în orice fază) transferul de efuziune al atomilor sau moleculelor gazoase dintr-un recipient într-un vid prin deschideri foarte mici Legea lui Graham a ratelor de efuziune de difuzie și efuziune a gazelor sunt invers proporționale cu rădăcinile pătrate ale maselor lor moleculare

Lasă un răspuns