Legarea în etan
în molecula de etan, imaginea de legare conform teoriei orbitale a valenței este foarte similară cu cea a metanului. Ambii atomi de carbon sunt hibridizați sp3, ceea ce înseamnă că ambele au patru legături aranjate cu geometria tetraedrică. Legătura carbon-carbon, cu o lungime de legătură de 1.,54 Å, este format prin suprapunerea unui orbital sp3 din fiecare dintre atomi de carbon, în timp ce cele șase legături carbon-hidrogen sunt formate din suprapuneri între orbitalii sp3 rămași pe cei doi atomi de carbon și orbitalii 1s ai atomilor de hidrogen. Toate acestea sunt obligațiuni sigma.

deoarece sunt formate din suprapunerea de la capăt la capăt a două orbite, legăturile sigma sunt libere să se rotească. Aceasta înseamnă, în cazul moleculei de etan, că cele două grupuri de metil (CH3) pot fi reprezentate ca două roți pe un butuc, fiecare putând să se rotească liber în raport cu cealaltă.,
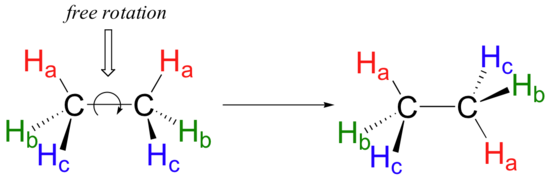
în capitolul 3 vom afla mai multe despre implicațiile libertății de rotație în legăturile sigma, atunci când vom discuta despre „conformația” moleculelor organice.imaginea de lipire sp3 este de asemenea folosită pentru a descrie legarea în amine, inclusiv amoniacul, cea mai simplă amină. La fel ca atomul de carbon din metan, azotul central din amoniac este hibridizat sp3., Cu azot, totuși, există cinci electroni de valență mai degrabă decât patru, ceea ce înseamnă că trei dintre cei patru orbitali hibrizi sunt pe jumătate umpluți și disponibili pentru lipire, în timp ce al patrulea este ocupat complet de o pereche de electroni (care nu leagă).C2H4, de asemenea, cunoscut sub numele de etilenă sau etenă, este un material gazos creat sintetic prin cracare cu abur. În natură, este eliberat în cantități mici de plante pentru a semnala fructele lor să se coacă. Etena constă din doi atomi de carbon hibridizați sp2, care sunt legați sigma între ei și la doi atomi de hidrogen fiecare., Orbitalii p rămași pe carbon formează o legătură pi, care dă etenei reactivitatea sa.

Lasă un răspuns