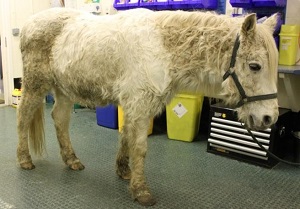
Pony con hipertricosis. Crédito de la imagen: Edd Knowles
a pesar de su nombre comúnmente utilizado de la enfermedad de Cushing equina, los aspectos más interesantes de la disfunción intermedia pars pituitaria equina (PPID) son, de hecho, sus diferencias con el síndrome de Cushing, ya sea en humanos o perros., Como sugiere el nombre recomendado PPID, esta es una enfermedad que afecta a la pars intermedia de la glándula pituitaria, no a la pars distalis o a la glándula suprarrenal. Esto repercute en las mejores formas de diagnosticar y tratar la enfermedad.
fisiopatología subyacente
todavía se desconocen muchos aspectos de la fisiopatología de este trastorno. Sin embargo, los fundamentos son relativamente indiscutibles. Es una enfermedad neurodegenerativa que afecta a las neuronas dopaminérgicas periventriculares del hipotálamo.,1,2 la pérdida de dopamina en el lóbulo intermedio de la glándula pituitaria previene los efectos inhibitorios de la estimulación del receptor dopaminérgico D2 en las membranas celulares de los melanotrofos.
en salud, esta inhibición resulta en una disminución en la síntesis y liberación de péptidos derivados de Pars intermedia pro-opiomelanocortin (POMC) y una disminución en la proliferación de melanotropos., La pérdida de inhibición mediada por dopamina inicialmente resulta en hipertrofia e hiperplasia del lóbulo intermedio, con un aumento de la hormona estimulante de α-melanocitos circulante (α-MSH), adrenocorticotropina (ACTH), β-endorfina y péptido intermedio similar a la corticotropina (CLIP).3 con la progresión de la enfermedad, la pars intermedia se agranda aún más, formando un adenoma que puede comprimir las estructuras hipofisarias, hipotalámicas y cerebrales adyacentes.4
todavía se desconoce la causa de la degeneración de los nervios que contienen dopamina., No hay evidencia de acumulación de marcadores de estrés oxidativo,2 mal plegadas terminal nerviosa proteins2 y posiblemente alterado el despacho de la proteína,5 pero si estas son las causas o consecuencias de la enfermedad, aún no probada.
dificultades del diagnóstico
El diagnóstico de la PPID puede ser desafiante y controvertido. Al igual que con muchas enfermedades progresivas, la identificación de los casos avanzados es sencilla, pero la de los casos tempranos es más difícil.,
‘los aspectos más interesantes del PPID equino son, de hecho, sus diferencias con el síndrome de Cushing’
una complicación adicional específica de los équidos está relacionada con su adaptación a la supervivencia en climas templados. Los caballos, y particularmente los ponis, tienen la capacidad de regular su metabolismo para almacenar energía cuando los nutrientes están fácilmente disponibles en la primavera y el verano, en preparación para el otoño y el invierno cuando los nutrientes son escasos., Los cambios de temperatura estacionales resultan en el crecimiento de una capa de pelo largo en invierno que se desprende en la primavera. La pars intermedia está involucrada en estos cambios estacionales, como lo demuestra la variación estacional en las concentraciones de ACTH y MSH6,la respuesta del cortisol a la supresión de dexametasona 7 y la respuesta de la ACTH a la estimulación de la hormona liberadora de tirotrofina (TRH).,8,9
Los estudios que investigan métodos diagnósticos a menudo se ven obstaculizados por la falta de una prueba ante-mortem «estándar de oro», y los estudios que utilizan el diagnóstico post-mortem también pueden ser defectuosos debido a la variación estacional en la apariencia histológica del intermediario de pars10 y las inconsistencias en los diagnósticos histológicos entre patólogos.11 se han hecho avances recientes en el diagnóstico post mortem; 12 el uso de estos métodos puede permitir una mayor investigación de las pruebas ante mortem., La única prueba que no resulta en falsos positivos es la presencia de hipertricosis, un signo clínico patognomónico presente en los estadios más avanzados de la enfermedad.
las recomendaciones actuales para el diagnóstico se basan en un algoritmo diseñado por el grupo de Endocrinología Equina.13 en animales que muestran signos clínicos evidentes de PPID, la ACTH en reposo es la prueba de primera línea. Si esto es alto, comparado con el rango de referencia ajustado estacionalmente, 14, 15 entonces el tratamiento debe ser instigado., Si la ACTH en reposo es normal, y en animales con signos sutiles de PPID, se debe realizar la prueba de estimulación de la TRH y medir la ACTH.16 se observa una respuesta exagerada en individuos afectados por PPID.
la Laminitis se ha relacionado durante mucho tiempo con la PPID. La teoría actual es que la hiperinsulinemia es el principal factor de riesgo de laminitis, y la PPID puede ser un factor de riesgo de hiperinsulinemia. La prueba actual recomendada para el riesgo de hiperinsulinemia clínicamente significativa es la medición de la respuesta de la insulina al azúcar oral., Si se observa una respuesta exagerada, se requiere un manejo para reducir el acceso a los pastos y altos niveles de alimentación con carbohidratos no estructurales.
enfoques del tratamiento
el tratamiento ha variado a lo largo de los años, pero, desde la autorización del mesilato de pergolida para su uso en la PPID en caballos en 2011 (Prascend®; Boehringer Ingelheim Vetmedica), las alternativas de ciproheptadina (un antagonista de la serotonina) y trilostano (un inhibidor de la esteroidogénesis suprarrenal) rara vez se utilizan.,
Pergolide es un agonista del receptor de dopamina, que actúa para restaurar la inhibición mediada por el receptor de dopamina de los melanotrofos de la pars intermedia. El tratamiento con pergolida reduce las concentraciones basales de ACTH17 y mejora los signos clínicos en la mayoría de los casos, siendo el efecto secundario más frecuente la inapetencia.Si pergolida no produce una mejoría suficiente, se puede probar el tratamiento con ciproheptadina.
mejora del Pronóstico
mientras que el tratamiento puede mejorar los signos clínicos y la calidad de vida de los caballos con PPID, la condición solo puede controlarse y no curarse., La enfermedad afecta a animales de mediana edad a mayores, con diversos grados de los siguientes signos clínicos: hipertricosis, sudoración anormal, predisposición a laminitis y/o infecciones, pérdida de masa muscular, letargo, poliuria y polidipsia.20 la combinación de un tratamiento farmacológico eficaz y de apoyo puede conducir anecdóticamente a una mejora de la calidad de vida durante varios años, aunque faltan estudios controlados aleatorios en esta área.,
el PPID equino tiene pocas similitudes con el síndrome de Cushing humano o canino; reconocer las diferencias entre las condiciones ha facilitado el progreso en las áreas desafiantes de comprender la fisiopatología del PPID equino y la mejor manera de diagnosticarlo.
Elizabeth Finding
Anatomy Demonstrator, Royal Veterinary College, London
- McFarlane D 2007 Ageing Research Reviews 6 54-63.
- McFarlane D et al. 2005 Journal of Neuroendocrinology 17 73-80.
- Orth DN et al. 1982 Endocrinology 110 1430-1441.
- Boujon CE et al., 1993 Journal of Comparative Pathology 109 163-178.
- McFarlane D et al. 2011 Journal of Veterinary Internal Medicine 25 750 Abst 85B.
- Beech J et al. 2009 Journal of the American Veterinary Medical Association 235 715-722.
- Donaldson MT et al. 2005 Journal of Veterinary Internal Medicine 19 217-222.
- Diez de Castro e et al. 2014 Endocrinología De Animales Domésticos 48 77-83.
- Fredrick J et al. 2014 Journal of Veterinary Internal Medicine 28 1104 Abst E-8.
- Cordero M et al. 2012 Journal of Equine Veterinary Science 32 75-79.
- McFarlane D et al., 2005 American Journal of Veterinary Research 66 2055-2059.
- Leitenbacher j & Herbach n 2016 Journal of Comparative Pathology 154 215-224.
- Frank N et al. 2015 recomendaciones para el diagnóstico y tratamiento de PPID
- Copas VEN & Durham ae 2012 Equine Veterinary Journal 44 440-443.
- McGowan TW et al. 2013 Equine Veterinary Journal 45 66-73.
- Beech J et al. 2011 Journal of the American Veterinary Medical Association 238 1305-1315.
- McFarlane D et al., 2016 Journal of Veterinary Pharmacology and Therapeutics doi: 10.1111/jvp.12339.
- Donaldson MT et al. 2002 Journal of Veterinary Internal Medicine 16 742-746.
- Perkins GA et al. 2002 Equine Veterinary Journal 34 679-685.
- McFarlane D 2011 Veterinary Clinics of North America: Equine Practice 27 93-113.

Deja una respuesta