objectifs D’apprentissage
à la fin de cette section, vous serez en mesure de:
- définir et expliquer l’épanchement et la diffusion
- Énoncer la loi de Graham et l’utiliser pour calculer les propriétés pertinentes des gaz
Si vous avez déjà été dans une pièce lors de la livraison d’une pizza chaude, du fait que les molécules gazeuses peuvent se propager rapidement dans une pièce, comme en témoigne l’arôme agréable qui atteint bientôt votre nez., Bien que les molécules gazeuses voyagent à des vitesses énormes (des centaines de mètres par seconde), elles entrent en collision avec d’autres molécules gazeuses et voyagent dans de nombreuses directions différentes avant d’atteindre la cible souhaitée. À température ambiante, une molécule gazeuse subira des milliards de collisions par seconde. Le chemin libre moyen est la distance moyenne parcourue par une molécule entre les collisions., Le libre chemin moyen augmente avec la diminution de la pression; en général, le libre chemin moyen pour une molécule gazeuse sera des centaines de fois le diamètre de la molécule
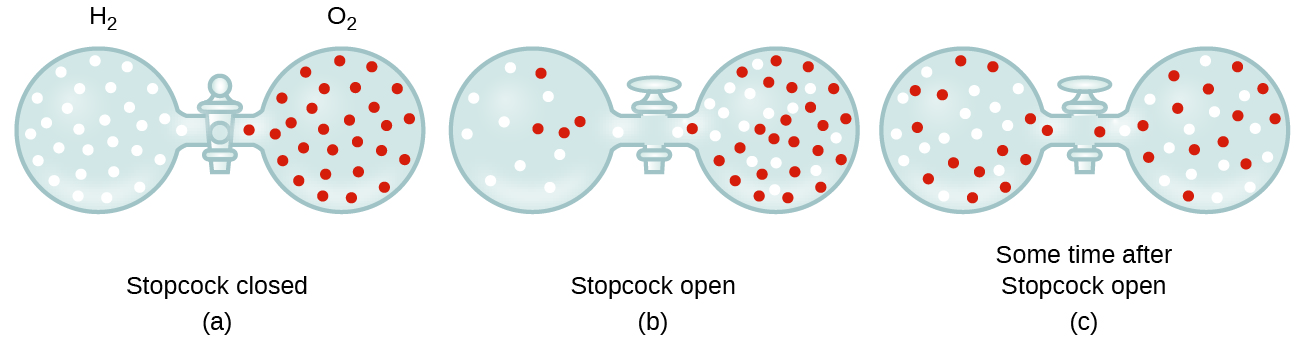
en général, nous savons que lorsqu’un échantillon de gaz est introduit dans une partie d’un récipient fermé, ses molécules se dispersent très rapidement dans le récipient; ce processus par lequel les molécules se dispersent dans l’espace en réponse à des différences de concentration est appelé diffusion (illustré à la Figure 1)., Les atomes ou les molécules gazeuses ne sont, bien sûr, pas conscients de tout gradient de concentration, ils se déplacent simplement de manière aléatoire—les régions de concentration plus élevée ont plus de particules que les régions de concentrations plus faibles, et donc un mouvement net des espèces des zones de concentration élevée à faible a lieu. Dans un environnement fermé, la diffusion aboutira finalement à des concentrations égales de gaz partout, comme le montre la Figure 1., Les atomes et les molécules gazeuses continuent de se déplacer, mais comme leurs concentrations sont les mêmes dans les deux bulbes, les taux de transfert entre les bulbes sont égaux (aucun transfert net de molécules ne se produit).
Nous sommes souvent intéressés par le taux de diffusion, la quantité de gaz traversant une zone Par unité de temps:
le taux de diffusion dépend de plusieurs facteurs: le gradient de concentration (l’augmentation ou la diminution de la concentration d’un point à un autre); la quantité de surface disponible pour la diffusion; et la distance que les particules de gaz doivent parcourir., On notera également que le temps nécessaire à la diffusion est inversement proportionnel au taux de diffusion, comme le montre l’équation du taux de diffusion.
un processus impliquant le mouvement d’espèces gazeuses similaires à la diffusion est l’épanchement, l’échappement de molécules de gaz à travers un trou minuscule tel qu’un trou d’épingle dans un ballon dans le vide (Figure 2). Bien que les vitesses de diffusion et d’épanchement dépendent toutes deux de la masse molaire du gaz impliqué, leurs vitesses ne sont pas égales; cependant, les rapports de leurs vitesses sont les mêmes.,
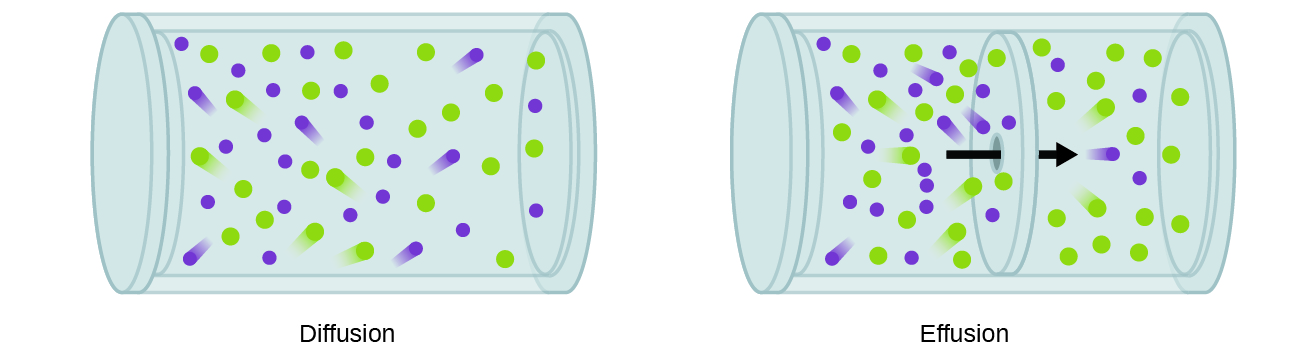
Si un mélange de gaz est placé dans un récipient à parois poreuses, les gaz se répandre à travers les petites ouvertures dans les murs. Les gaz les plus légers traversent les petites ouvertures plus rapidement (à un taux plus élevé) que les plus lourds (Figure 3).,particules:
Cela signifie que si deux gaz A et B sont à la même température et à la pression, le rapport de leur épanchement taux est inversement proportionnel au rapport des racines carrées des masses de leurs particules:

Voici un autre exemple, faisant le point sur la façon dont la détermination des temps diffère de la détermination des taux.,
enfin, voici un autre exemple montrant comment calculer la masse molaire à partir des données de taux d’épanchement.
utilisation de la Diffusion pour les applications de l’énergie nucléaire: enrichissement de l’Uranium
la diffusion gazeuse a été utilisée pour produire de l’uranium enrichi destiné à être utilisé dans des centrales nucléaires et des armes nucléaires. L’uranium naturel ne contient que 0,72% de 235U, le type d’uranium « fissile”, c’est-à-dire capable de soutenir une réaction en chaîne de fission nucléaire. Les réacteurs nucléaires ont besoin de combustible 2-5% 235U, et les bombes nucléaires ont besoin de concentrations encore plus élevées., Une façon d’enrichir l’uranium aux niveaux souhaités est de tirer parti de la loi de Graham. Dans une usine d’enrichissement par diffusion gazeuse, l’hexafluorure d’uranium (UF6, le seul composé d’uranium suffisamment Volatil pour fonctionner) est lentement pompé à travers de grands récipients cylindriques appelés diffuseurs, qui contiennent des barrières poreuses avec des ouvertures microscopiques. Le processus est celui de la diffusion car l’autre côté de la barrière n’est pas évacué. Les molécules 235UF6 ont une vitesse moyenne plus élevée et diffusent à travers la barrière un peu plus rapidement que les molécules 238uf6 plus lourdes., Le gaz qui a traversé la barrière est légèrement enrichi en 235uf6 et le gaz résiduel est légèrement appauvri. La petite différence de poids moléculaire entre 235uf6 et 238uf6 seulement environ 0,4% d’enrichissement, est atteint dans un diffuseur (Figure 4). Mais en connectant de nombreux diffuseurs dans une séquence d’étapes (appelée cascade), le niveau d’enrichissement souhaité peut être atteint.
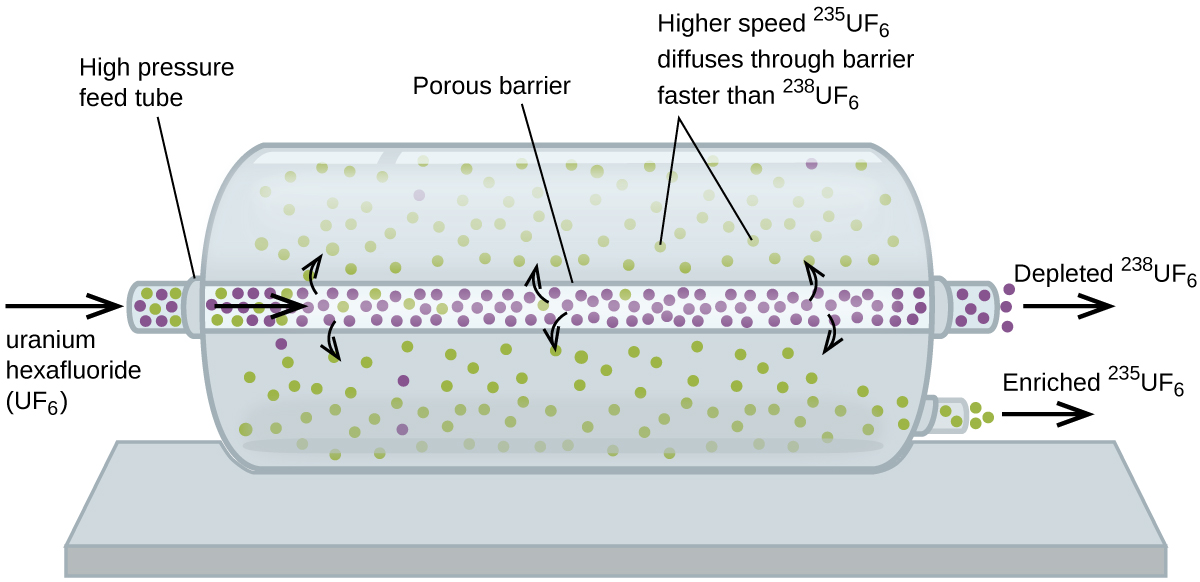
38uf6 a été fait pour la première fois pendant la Seconde Guerre mondiale, à L’installation d’énergie atomique à Oak Ridge, Tennessee, dans le cadre du Projet Manhattan (le développement de la première bombe atomique)., Bien que la théorie soit simple, cela a nécessité de surmonter de nombreux défis techniques intimidants pour le faire fonctionner dans la pratique. La barrière doit avoir des trous minuscules et uniformes (environ 10-6 cm de diamètre) et être suffisamment poreux pour produire des débits élevés. Tous les matériaux (la Barrière, Les tubes, les revêtements de surface, les lubrifiants et les joints) doivent pouvoir contenir, mais ne pas réagir avec, L’UF6 hautement réactif et corrosif.,
parce que les installations de diffusion gazeuse nécessitent de très grandes quantités d’énergie (pour comprimer le gaz aux hautes pressions requises et le conduire à travers la cascade du diffuseur, pour éliminer la chaleur produite lors de la compression, etc.), elle est maintenant remplacée par la technologie des centrifugeuses à gaz, qui nécessite beaucoup moins d’énergie. Un courant chaud question politique est de savoir comment refuser cette technologie à l’Iran, de l’empêcher de produire suffisamment d’uranium enrichi pour de les utiliser pour fabriquer des armes nucléaires.
Les Atomes et les molécules gazeuses se déplacent librement et aléatoirement dans l’espace., La Diffusion est le processus par lequel des atomes et des molécules gazeuses sont transférés de régions de concentration relativement élevée à des régions de concentration relativement faible. L’épanchement est un processus similaire dans lequel les espèces gazeuses passer d’un conteneur vide par de très petits orifices. Les taux d’épanchement des gaz sont inversement proportionnels aux racines carrées de leurs densités ou aux racines carrées des masses de leurs atomes/molécules (loi de Graham).,
équations clés
Chimie exercices de fin de chapitre
- Un ballon rempli d’hélium gazeux MET 6 heures à se dégonfler à 50% de son volume d’origine. Combien de temps faudra-t-il pour qu’un ballon identique rempli du même volume d’hydrogène gazeux (au lieu de l’hélium) diminue son volume de 50%?
- expliquer pourquoi les nombres de molécules ne sont pas identiques dans les ampoules de gauche et de droite illustrées dans l’illustration centrale de la Figure 1.,
- En commençant par la définition de la vitesse d’épanchement et la découverte de Graham reliant la vitesse et la masse molaire, montrer comment dériver L’équation de la Loi de Graham, reliant les vitesses relatives d’épanchement pour deux gaz à leurs masses moléculaires.
- l’eau lourde, D2O (masse molaire = 20,03 g mol-1), peut être séparée de L’eau ordinaire, H2O (masse molaire = 18,01), en raison de la différence dans les vitesses relatives de diffusion des molécules en phase gazeuse. Calculer les vitesses relatives de diffusion de H2O et D2O.
- lequel des gaz suivants diffuse plus lentement que l’oxygène?, F2, Ne, N2O, C2H2, NO, Cl2, H2S
- au cours de la discussion sur la diffusion gazeuse pour enrichir l’uranium, il a été affirmé que
235uf6 diffuse 0,4% plus rapidement que 238UF6. Afficher le calcul qui prend en charge cette valeur. La masse molaire de 235UF6 = 235,043930 + 6 × 18,998403 = 349,034348 g/mol, et la masse molaire de 238UF6 = 238,050788 + 6 × 18,998403 = 352,041206 g/mol. - calculer la vitesse relative de diffusion de 1H2 (masse molaire 2,0 g/mol) par rapport à celle de 2H2 (masse molaire 4.,0 g / mol) et la vitesse relative de diffusion de L’O2 (masse molaire 32 g/mol) par rapport à celle de L’O3 (masse molaire 48 g/mol).
- un gaz d’identité inconnue diffuse à une vitesse de 83,3 mL/s dans un appareil de diffusion dans lequel le dioxyde de carbone diffuse à une vitesse de 102 mL / s. calculer la masse moléculaire du gaz inconnu.
- lorsque deux bouchons de coton, l’un humidifié avec de l’ammoniac et l’autre avec de l’acide chlorhydrique, sont simultanément insérés aux extrémités opposées d’un tube de verre de 87,0 cm de long, un anneau blanc de NH4Cl se forme où le NH3 gazeux et le HCl gazeux entrent en contact., (Astuce: Calculez les vitesses de diffusion pour le NH3 et le HCl, et découvrez combien le NH3 diffuse plus rapidement que le HCl.) \text {NH}_3(g) + \text{HCl} (g) \longrightarrow \text{NH}_4 \text{Cl} (s)
à environ quelle distance du bouchon humidifié à l’ammoniac cela se produit-il?,m ou molécule d’une région de concentration relativement élevée à une région de concentration relativement faible (discutée dans ce chapitre en ce qui concerne les espèces gazeuses, mais applicable aux espèces dans n’importe quelle phase) épanchement transfert d’atomes ou de molécules gazeuses d’un récipient à un vide par de très petites ouvertures loi de Graham sur l’épanchement les vitesses de diffusion et d’épanchement des gaz sont inversement proportionnelles aux racines carrées de leurs masses moléculaires chemin libre moyen distance moyenne d’une molécule entre les collisions vitesse de diffusion quantité de gaz diffusant à travers une zone donnée pendant un temps donné

Laisser un commentaire